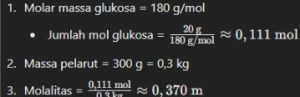Molaritas dan Molalitas: Memahami Dua Konsep Penting dalam Kimia
Dalam dunia kimia, pemahaman tentang larutan sangatlah penting. Salah satu aspek utama dalam studi larutan adalah konsentrasi, yang dapat diukur dalam dua cara, yaitu molaritas dan molalitas. Kedua istilah ini sering digunakan dalam eksperimen laboratorium dan aplikasinya dalam kehidupan sehari-hari.
Artikel ini akan membahas secara mendalam mengenai pengertian, manfaat, rumus, serta perbedaan antara molaritas dan molalitas.
Apa Itu Molaritas dan Molalitas?
Molaritas (M) adalah ukuran konsentrasi larutan yang dinyatakan dalam jumlah mol solut per liter larutan. Sederhananya, molaritas mengukur seberapa banyak zat terlarut yang ada dalam volume larutan tertentu. Konsep ini sangat penting dalam banyak reaksi kimia, karena mempengaruhi laju dan hasil reaksi.
Sementara itu, molalitas (m) adalah ukuran konsentrasi larutan yang dinyatakan dalam jumlah mol solut per kilogram pelarut. Molalitas lebih tepat digunakan dalam situasi di mana suhu larutan dapat bervariasi, karena molalitas tidak terpengaruh oleh perubahan suhu. Hal ini membuat molalitas menjadi pilihan yang lebih baik dalam penelitian yang membutuhkan akurasi tinggi.
Manfaat Molaritas dan Molalitas
Manfaat Molaritas
- Pengukuran yang Mudah: Molaritas memberikan cara sederhana untuk menghitung konsentrasi larutan, sehingga mudah dipahami dan diterapkan dalam eksperimen.
- Relevansi dalam Reaksi Kimia: Dalam banyak reaksi kimia, molaritas membantu dalam perhitungan stoikiometri, memungkinkan peramal reaksi yang lebih akurat.
- Standarisasi: Molaritas memungkinkan perbandingan antara berbagai larutan, membuatnya lebih mudah untuk menentukan konsentrasi yang tepat untuk berbagai aplikasi.
Manfaat Molalitas
- Stabilitas Terhadap Suhu: Karena molalitas tidak dipengaruhi oleh suhu, hal ini membuatnya lebih stabil untuk penggunaan dalam kondisi ekstrem.
- Pengukuran yang Akurat: Dalam penelitian yang memerlukan ketepatan tinggi, molalitas memberikan hasil yang lebih konsisten dibandingkan molaritas.
- Aplikasi dalam Kalorimetri: Molalitas sering digunakan dalam studi kalorimetri, di mana perubahan energi dalam larutan penting untuk dipahami.
Baca Juga : Ruang Lingkup Geografi: Membahas Ilmu yang Menjelajahi Dunia dan Lingkungan Kita
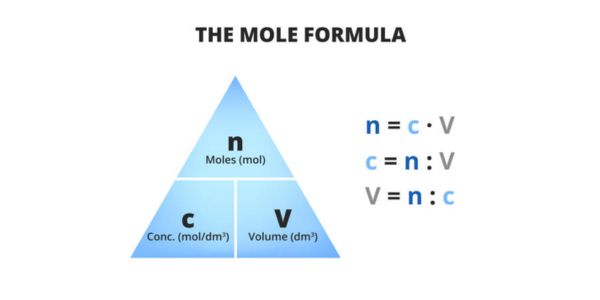
Rumus Molaritas dan Molalitas
Rumus Molaritas
Rumus untuk menghitung molaritas adalah sebagai berikut:
Contoh: Jika 2 mol garam dilarutkan dalam 1 liter air, maka molaritas larutan tersebut adalah 2 M.
Rumus Molalitas
Rumus untuk menghitung molalitas adalah:
Contoh: Jika 1 mol gula dilarutkan dalam 0,5 kg air, maka molalitasnya adalah 2 m.
Perbedaan Antara Molaritas dan Molalitas
Meskipun kedua konsep ini digunakan untuk mengukur konsentrasi larutan, ada beberapa perbedaan mendasar:
- Basis Pengukuran: Molaritas diukur per liter larutan, sedangkan molalitas diukur per kilogram pelarut.
- Pengaruh Suhu: Molaritas dipengaruhi oleh perubahan suhu, sedangkan molalitas tetap konstan meskipun suhu berubah.
- Kegunaan: Molaritas lebih sering digunakan dalam reaksi kimia di laboratorium, sedangkan molalitas lebih tepat untuk aplikasi yang memerlukan akurasi tinggi dalam perhitungan energi.
Baca Juga : Apa Itu Atom? Mengenal Unit Terkecil Pembentuk Materi
Proses Menghitung Molaritas dan Molalitas
Untuk menghitung molaritas dan molalitas, penting untuk memahami langkah-langkah yang terlibat. Mari kita lihat prosesnya satu per satu.
Menghitung Molaritas
- Tentukan jumlah zat terlarut dalam mol: Misalkan, kita memiliki 5 gram natrium klorida (NaCl). Pertama, kita perlu menghitung jumlah mol NaCl.
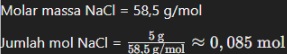
- Tentukan volume larutan dalam liter: Jika kita melarutkan NaCl tersebut dalam 500 mL air, kita perlu mengubah volume ini menjadi liter.
Volume larutan = 500 mL = 0,5 L - Hitung molaritas:
Menghitung Molalitas
- Hitung jumlah mol zat terlarut: Dari contoh sebelumnya, kita sudah mengetahui bahwa kita memiliki 0,085 mol NaCl.
- Tentukan massa pelarut dalam kilogram: Jika kita menggunakan 500 mL air, kita bisa menghitung massa air tersebut.
Massa air = 500 g = 0,5 kg - Hitung molalitas:
Contoh Soal dan Pembahasan
Mari kita lihat beberapa contoh soal yang dapat membantu dalam memahami konsep molaritas dan molalitas.
Soal 1: Menghitung Molaritas
Jika 10 gram kalium klorida (KCl) dilarutkan dalam 250 mL air, berapakah molaritas larutan tersebut?
Pembahasan:
Soal 2: Menghitung Molalitas
Jika 20 gram glukosa (C6H12O6) dilarutkan dalam 300 g air, berapakah molalitas larutan tersebut?
Pembahasan:
Memahami konsep molaritas dan molalitas sangatlah penting bagi pelajar dan praktisi kimia. Kedua istilah ini tidak hanya membantu dalam pengukuran konsentrasi larutan tetapi juga menjadi dasar untuk berbagai aplikasi kimia. Dengan mengetahui rumus dan perbedaan antara keduanya, kita dapat lebih efektif dalam melakukan eksperimen dan analisis di laboratorium.
Bagi yang ingin memperdalam pemahaman di bidang kimia dan berbagai mata pelajaran lainnya, jangan ragu untuk mendaftar dan belajar di Aplikasi Belajar dari StudioBelajar. Dengan platform ini, pembelajaran menjadi lebih mudah, menyenangkan, dan efektif. Ayo bergabung dan tingkatkan kemampuan belajar Anda sekarang!