Kelarutan dan Hasil Kali Kelarutan (KSP)
Pelarutan dan pengendapan merupakan reaksi kimia yang umum terjadi di sekitar kehidupan kita sehari-hari dan bahkan di dalam tubuh kita. Enamel gigi yang komposisi utamanya adalah mineral hidroksiapatit [Ca5(PO4)3OH] dapat mengalami pelarutan dalam medium bersifat asam yang secara lanjut akan menyebabkan karies gigi.
Pengendapan garam-garam tertentu dalam ginjal akan menyebabkan terbentuknya batu ginjal. Pengendapan CaCO3 dari air tanah memegang peranan penting dalam pembentukan stalaktit dan stalagmit. Selain itu, air laut dengan konsentrasi ion-ion Ca2+ dan CO32− cukup tinggi turut berpengaruh terhadap keberadaan terumbu karang yang tersusun dari CaCO3.
Hukum Dasar Kimia
Senyawa Karbon
Rumus Empiris dan Rumus Molekul
Pada pembahasan mengenai reaksi pengendapan dalam artikel “Kelarutan Garam”, telah dijelaskan petunjuk umum memprediksikan kelarutan garam dalam air yang merupakan aspek kualitatif kesetimbangan larutan. Selanjutnya, artikel ini akan memfokuskan pembahasan pada prediksi kelarutan dari aspek kuantitatif.
Kelarutan (s)
Jika kita melarutkan sedikit garam dapur (NaCl), misalnya 10 g ke dalam 100 mL air pada suhu ruang, maka seluruh NaCl akan larut. Bagaimana bila kita menambahkan lebih banyak NaCl? Apakah tambahan NaCl tersebut masih akan larut? Adakah batasan di mana NaCl tidak dapat larut lagi?
Bila kita melarutkan 100 g NaCl ke dalam 100 mL air, maka sebagian NaCl akan tidak larut. Pada kondisi ini, larutan dikatakan “jenuh”. Larutan jenuh adalah larutan di mana pelarut tidak dapat melarutkan zat terlarut lagi sehingga terdapat zat terlarut yang tidak larut (mengendap). Kelarutan (solubility) didefinisikan sebagai jumlah maksimum zat yang dapat larut dalam sejumlah tertentu pelarut pada suhu tertentu. Kelarutan suatu zat biasanya dinyatakan dalam satuan g/L atau mol/L. Kelarutan yang dinyatakan dalam mol/L biasanya disebut sebagai kelarutan molar, s.
Contoh Soal Kelarutan:
Dalam 500 mL larutan jenuh kalsium fluorida (CaF2) terdapat 8,2 mg CaF2. Tentukan kelarutan CaF2 dalam mol/L.
Pembahasan:
Kelarutan molar = molaritas larutan jenuh; s = n / V. Jadi, massa zat terlarut harus dikonversi terlebih dahulu menjadi jumlah mol zat terlarut. Lalu, molaritas larutan ditentukan dari jumlah mol zat terlarut per satuan volum larutan.
Jumlah mol CaF2 = =
Kelarutan CaF2 = s = =
.
Tetapan Hasil Kali Kelarutan (Ksp)
Dalam larutan jenuh, semua zat terlarut yang berwujud padat juga masih akan terus melarut. Namun, secara bersamaan juga ada zat terlarut yang telah larut berubah kembali menjadi padat dengan laju yang sama. Dengan kata lain, dalam larutan jenuh terdapat kesetimbangan dinamis zat terlarut yang padat dengan yang larut.
Sebagai contoh, pada larutan jenuh BaSO4 terdapat kesetimbangan antara proses pelarutan padatan BaSO4 sehingga terdisosiasi menjadi ion-ion Ba2+ dan SO42− dengan proses pengendapan BaSO4 dari interaksi elektrostatik tarik-menarik ion Ba2+ dengan ion SO42−.
BaSO4(s) ⇌ Ba2+(aq) + SO42−(aq)
Tetapan kesetimbangan kelarutan padatan ionik dengan ion-ionnya yang terlarut disebut tetapan hasil kali kelarutan (solubility product constant), Ksp. Tetapan hasil kali kelarutan untuk BaSO4, yaitu:
Ksp = [Ba2+][SO42−]
Secara umum, persamaan Ksp untuk senyawa ionik AxBy adalah:
AxBy(s) ⇌ xAm+(aq) + yBn−(aq)
Ksp = [Am+]x[Bn−]y
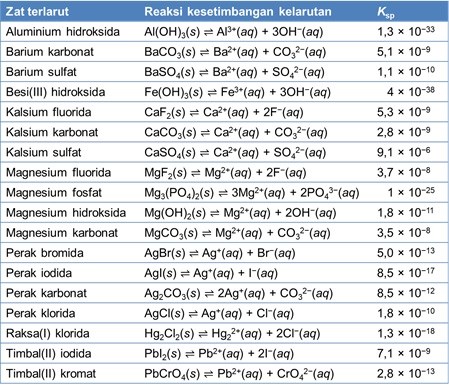
Nilai Ksp hanya bergantung pada temperatur, sama seperti tetapan kesetimbangan lainnya. Tabel berikut menunjukkan nilai Ksp dari beberapa senyawa ionik pada 25°C. Senyawa-senyawa ionik yang mudah larut seperti NaCl dan KNO3 memiliki nilai Ksp yang sangat besar namun tidak akurat sehingga tidak terdaftar dalam tabel. Rendahnya akurasi disebabkan oleh tingginya konsentrasi ion-ion pada larutan jenuhnya sehingga larutan menjadi tidak ideal.
Hubungan Kelarutan (s) dan Tetapan Hasil Kali Kelarutan (Ksp)
Kelarutan dari suatu zat dapat berubah bergantung pada beberapa faktor. Misalnya, kelarutan dari senyawa hidroksida seperti Mg(OH)2, bergantung pada pH larutan. Kelarutan zat juga dipengaruhi oleh konsentrasi ion-ion lain dalam larutan, khususnya ion-ion senama. Dengan kata lain, nilai kelarutan dari suatu zat terlarut akan berubah jika spesi lain dalam larutan berubah. Hal ini berbeda dengan Ksp, nilai Ksp dari suatu zat terlarut selalu tetap pada setiap temperatur yang spesifik. Untuk memahami hubungan s dan Ksp, perhatikan kesetimbangan kelarutan dalam larutan jenuh Ag2CO3 berikut.
Ag2CO3(s) ⇌ 2Ag+(aq) + CO32−(aq)
Konsentrasi ion Ag+ dan ion CO32− dalam larutan jenuh pada saat setimbang dapat dikaitkan dengan kelarutan Ag2CO3 sesuai dengan stoikiometri perbandingan koefisien reaksi. Jika kelarutan Ag2CO3 dinyatakan dengan s, maka konsentrasi ion Ag+ sama dengan 2s dan konsentrasi ion CO32− sama dengan s.
Ag2CO3(s) ⇌ 2Ag+(aq) + CO32−(aq)

Dengan demikian, hubungan s dan Ksp Ag2CO3 dapat dinyatakan sebagai berikut.

Pengaruh Ion Senama terhadap Kelarutan
Berdasarkan asas Le Châtelier, bila pada campuran yang berada dalam kesetimbangan dinaikkan konsentrasi salah satu reaktannya maka kesetimbangan akan bergeser ke arah pengurangan jumlah reaktan tersebut. Jadi, kelarutan dari suatu senyawa ionik akan berkurang dengan adanya zat terlarut lain yang memiliki ion senama. Sebagai contoh, kelarutan AgCl dalam air murni akan lebih besar dibanding kelarutan AgCl dalam larutan NaCl.
Pada kesetimbangan kelarutan AgCl dalam larutan NaCl akan menyebabkan terbentuknya lebih banyak endapan AgCl jika dibanding dengan dalam air murni. Garam NaCl merupakan elektrolit kuat yang mudah terdisosiasi menjadi ion Na+ dan ion Cl−. Ion Cl− yang merupakan ion senama jika konsentrasinya bertambah, maka akan menyebabkan kesetimbangan bergeser ke arah pembentukan endapan AgCl. Akibatnya, kelarutan AgCl menjadi berkurang.

Pengaruh pH terhadap Kelarutan
Tingkat keasaman larutan (pH) dapat mempengaruhi kelarutan dari berbagai jenis zat, terutama senyawa hidroksida dan garam dari asam lemah yang sukar larut. Untuk lebih jelasnya, perhatikan kedua contoh berikut.
1. pH dan kelarutan senyawa hidroksida
Mg(OH)2(s) ⇌ Mg2+(aq) + 2OH−(aq) Ksp = 1,8 × 10−11
Larutan jenuh Mg(OH)2 memiliki pH = 10,52 dengan kelarutannya 1,7 × 10−4 mol/L.

Bila Mg(OH)2 dilarutkan dalam larutan buffer dengan pH = 9,0, maka pOH = 5,0 dan [OH−] = 1,0 × 10−5, maka melalui perhitungan persamaan tetapan kesetimbangan kelarutan Mg(OH)2 diperoleh:

Kelarutan Mg(OH)2 dalam larutan buffer pH 9,0 adalah 0,18 mol/L. Hal ini menunjukkan bahwa kelarutan Mg(OH)2 meningkat seiring dengan penurunan pH larutan.
Secara umum, jika pH mengalami penurunan, maka kelarutan senyawa hidroksida akan meningkat.
2. pH dan kelarutan garam dari asam lemah
Kelarutan PbF2 juga meningkat seiring bertambahnya keasaman larutan. Hal ini dikarenakan anion F− bersifat basa (F− adalah basa konjugasi dari asam lemah HF). Oleh karena itu, kesetimbangan kelarutan PbF2 bergeser ke kanan berhubung konsentrasi F− berkurang seiring protonasi membentuk HF.
PbF2(s) ⇌ Pb2+(aq) + 2F−(aq)
F−(aq) + H+(aq) ⇌ HF(aq)
Persamaan reaksi kesetimbangan keseluruhan untuk kedua reaksi tersebut, yaitu:
PbF2(s) + 2H+(aq) ⇌ Pb2+(aq) + 2HF(aq)
Garam lainnya dengan anion seperti CO32−, PO43−, CN−, dan S2− juga memiliki kecenderungan yang sama. Secara umum, jika pH mengalami penurunan, maka kelarutan garam dari asam lemah akan meningkat.
Memprediksikan Pengendapan
Pada pembahasan kesetimbangan kimia telah dijelaskan kuosien reaksi (Q) yang digunakan untuk menentukan arah berlangsungnya reaksi untuk mencapai kesetimbangan. Dalam kesetimbangan kelarutan, nilai Q adalah hasil kali konsentrasi molar ion-ion dalam larutan dengan asumsi zat terdisosiasi sempurna. Perbandingan nilai Q dengan Ksp dapat digunakan untuk memprediksikan terjadi atau tidaknya pengendapan, sebagaimana ketentuan berikut.
- Jika Q < Ksp, larutan belum jenuh dan tidak terbentuk endapan.
- Jika Q = Ksp, larutan tepat jenuh, namun belum terbentuk endapan.
- Jika Q > Ksp, terbentuk endapan.
Contoh Soal Kelarutan dan Hasil Kali Kelarutan (KSP) dan Pembahasan
Contoh Soal 1:
Hitunglah kelarutan Cu(OH)2 dalam satuan g/L, jika diketahui Ksp Cu(OH)2 = 2,2 × 10−20.
Pembahasan:


Contoh Soal 2:
Hitunglah kelarutan molar PbI2 dalam larutan KI 0,1 M. (Ksp PbI2 = 7,1 × 10−9)
Pembahasan:
Dalam larutan, KI akan terdisosiasi menjadi ion K+ dan ion I−. Pada larutan KI 0,1 M, [I−] = 0,1 M. Asumsikan s adalah jumlah mol PbI2 yang larut menghasilkan 1 L larutan jenuh, sehingga terdapat tambahan s mol Pb2+/L dan 2s mol I−/L.
PbI2(s) ⇌ Pb2+(aq) + 2I−(aq)
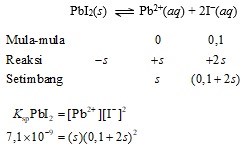
Oleh karena dapat diduga bahwa s ≪ 0,1, maka dapat diasumsikan (0,1 + 2s) ≈ 0,1.
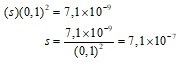
Jadi, kelarutan molar PbI2 dalam larutan KI 0,1 M adalah 7,1 × 10−7 mol/L.
Contoh Soal 3:
Sebanyak 100 mL Ca(NO3)2 0,3 M dicampurkan dengan 200 mL larutan NaF 0,06 M. Jika Ksp CaF2 = 3,2 × 10−11, apakah akan terbentuk endapan CaF2?
Pembahasan:
Untuk mengetahui terbentuk atau tidaknya endapan CaF2, kita perlu membandingkan nilai Q terhadap Ksp CaF2. Sebelum menentukan nilai Q, kita perlu mencari konsentrasi ion Ca2+ dan ion F− dalam campuran terlebih dahulu.
Dalam 100 mL Ca(NO3)2 0,3 M, jumlah mol Ca(NO3)2 = (0,3 mol/L)(0,1 L) = 0,03 mol
Dalam 200 mL NaF 0,06 M, jumlah mol NaF = (0,06 mol/L)(0,2 L) = 0,012 mol
Ca(NO3)2(aq) → Ca2+(aq) + 2NO3−(aq)
0,03 mol 0,03 mol 0,06 mol
NaF(aq) → Na+(aq) + F−(aq)
0,012 mol 0,012 mol 0,012 mol
Setelah pencampuran, [Ca2+] = dan [F−] =
.
Karena Q > Ksp, setelah pencampuran terbentuk endapan CaF2.
Referensi:
Atkins, Peter & Jones, Loretta. 2010. Chemical Principles: The Quest for Insight (5th edition). New York: W.H. Freeman & Company
Brown, Theodore L. et al. 2015. Chemistry: The Central Science (13th edition). New Jersey: Pearson Education, Inc.
Chang, Raymond & Goldsby, Kenneth A. 2016. Chemistry (12th edition). New York: McGraw-Hill Education
Johari, J.M.C. & Rachmawati, M. 2009. Kimia SMA dan MA untuk Kelas XI Jilid 2. Jakarta: Esis
Oxtoby, David W., Gillis, H.P., & Campion, Alan. 2012. Principles of Modern Chemistry (7th edition). California: Brooks/Cole, Cengage Learning
Petrucci, Ralph H. et al. 2017. General Chemistry: Principles and Modern Applications (11th edition). Toronto: Pearson Canada Inc.
Purba, Michael. 2006. Kimia 2B untuk SMA Kelas XI. Jakarta: Erlangga
Silberberg, Martin S. & Amateis, Patricia. 2015. Chemistry: The Molecular Nature of Matter and Change (7th edition). New York: McGraw-Hill Education
Kontributor: Nirwan Susianto, S.Si.
Alumni Kimia FMIPA UI
Materi StudioBelajar.com lainnya:
