Larutan Penyangga
Pengertian Larutan Penyangga
Larutan penyangga adalah suatu sistem larutan yang dapat mempertahankan nilai pH larutan agar tidak terjadi perubahan pH yang berarti oleh karena penambahan asam atau basa maupun pengenceran. Larutan ini disebut juga dengan larutan buffer atau dapar.
Dalam kehidupan sehari-hari, terdapat berbagai reaksi kimia yang merupakan reaksi asam basa. Sebagai contoh, reaksi beberapa enzim pencernaan dalam sistem biologis. Enzim pepsin yang berfungsi memecah protein dalam lambung hanya dapat bekerja optimal dalam suasana asam, yakni pada sekitar pH 2. Dengan kata lain, jika enzim berada pada kondisi pH yang jauh berbeda dari pH optimal tersebut, maka enzim dapat menjadi tidak aktif bahkan rusak. Oleh karena itu, perlu ada suatu sistem yang menjaga nilai pH di mana enzim tersebut bekerja. Sistem untuk mempertahankan nilai pH inilah yang disebut dengan larutan penyangga. Hal ini terjadi sebagaimana dalam larutan ini terdapat zat-zat terlarut bersifat “penahan” yang terdiri dari komponen asam dan basa. Komponen asam akan menahan kenaikan pH sedangkan komponen basa akan menahan penurunan pH.
Fungsi Larutan Penyangga
Larutan penyangga banyak digunakan dalam analisis kimia, biokimia dan mikrobiologi. Selain itu, dalam bidang industri, juga banyak digunakan pada proses seperti fotografi, electroplating (penyepuhan), pembuatan bir, penyamakan kulit, sintesis zat warna, sintesis obat-obatan, maupun penanganan limbah.
Di dalam tubuh makhluk hidup juga terdapat larutan penyangga yang sangat berperan penting. Dalam keadaan normal, pH darah manusia yaitu 7,4. pH darah tidak boleh turun di bawah 7,0 ataupun naik di atas 7,8 karena akan berakibat fatal bagi tubuh. pH darah dipertahankan pada 7,4 oleh larutan penyangga karbonat-bikarbonat (H2CO3/HCO3−) dengan menjaga perbandingan konsentrasi [H2CO3] : [HCO3−] sama dengan 1 : 20. Selain itu, dalam cairan intra sel juga terdapat larutan penyangga dihidrogenfosfat-monohidrogenfosfat (H2PO4−/HPO42−). Larutan penyangga H2PO4−/HPO42− juga terdapat dalam air ludah, yang berfungsi untuk menjaga pH mulut sekitar 6,8 dengan menetralisir asam yang dihasilkan dari fermentasi sisa-sisa makanan yang dapat merusak gigi.
Komponen Larutan Penyangga
Larutan penyangga asam
Larutan buffer asam mempertahankan pH pada suasana asam (pH < 7). Larutan buffer asam terdiri dari komponen asam lemah (HA) dan basa konjugasinya (A−). Larutan seperti ini dapat diperoleh dengan:
- mencampurkan asam lemah (HA) dengan garam basa konjugasinya (LA, yang dapat terionisasi menghasilkan ion A−)
- mencampurkan suatu asam lemah dalam jumlah berlebih dengan suatu basa kuat sehingga bereaksi menghasilkan garam basa konjugasi dari asam lemah tersebut.
Contoh: larutan penyangga yang mengandung CH3COOH dan CH3COO−
Dalam larutan tersebut, terdapat kesetimbangan kimia:
CH3COOH(aq) ⇌ CH3COO−(aq) + H+(aq)
Pada penambahan asam (H+), kesetimbangan akan bergeser ke arah kiri, sehingga reaksi mengarah pada pembentukan CH3COOH. Dengan kata lain, asam yang ditambahkan akan dinetralisasi oleh komponen basa konjugasi (CH3COO−).
Pada penambahan basa (OH−), kesetimbangan akan bergeser ke arah kanan, yakni reaksi pembentukan CH3COO− dan H+, sebagaimana untuk mempertahankan konsentrasi ion H+ yang menjadi berkurang karena OH− yang ditambahkan bereaksi dengan H+ membentuk H2O. Dengan kata lain, basa yang ditambahkan akan dinetralisasi oleh komponen asam lemah (CH3COOH).
Teorema Sisa dan Teorema Faktor
Struktur Proposal Kegiatan
Sel Hewan
Larutan penyangga basa
Larutan buffer basa mempertahankan pH pada suasana basa (pH > 7). Larutan buffer basa terdiri dari komponen basa lemah (B) dan basa konjugasinya (BH+). Larutan seperti ini dapat diperoleh dengan:
- mencampurkan basa lemah (B) dengan garam asam konjugasinya (BHX, yang dapat terionisasi menghasilkan ion BH+)
- mencampurkan suatu basa lemah dalam jumlah berlebih dengan suatu asam kuat sehingga bereaksi menghasilkan garam asam konjugasi dari basa lemah tersebut.
Contoh: larutan penyangga yang mengandung NH3 dan NH4+
Dalam larutan tersebut, terdapat kesetimbangan:
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)
Pada penambahan asam (H+), kesetimbangan akan bergeser ke arah kanan, yakni reaksi pembentukan NH4+ dan OH−, sebagaimana untuk mempertahankan konsentrasi ion OH− yang menjadi berkurang karena H+ yang ditambahkan bereaksi dengan OH− membentuk H2O. Dengan kata lain, asam yang ditambahkan akan dinetralisasi oleh komponen basa lemah (NH3).
Pada penambahan basa (OH−), kesetimbangan akan bergeser ke arah kiri, sehingga reaksi mengarah pada pembentukan NH3 dan air. Dengan kata lain, basa yang ditambahkan akan dinetralisasi oleh komponen asam konjugasi (NH4+).
pH Larutan Penyangga
Larutan penyangga asam
Dalam larutan buffer asam yang mengandung CH3COOH dan CH3COO−, terdapat kesetimbangan:
CH3COOH(aq) ⇌ CH3COO−(aq) + H+(aq)

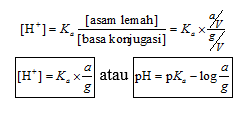
Setelah disusun ulang, persamaan pH larutan di atas akan menjadi persamaan larutan penyangga yang dikenal sebagai persamaan Henderson – Hasselbalch sebagaimana persamaan berikut ini:
Jika a = jumlah mol asam lemah, g = jumlah mol basa konjugasi, dan V = volum larutan penyangga,
Larutan penyangga basa
Dalam larutan buffer basa yang mengandung NH3 dan NH4+, terdapat kesetimbangan:
NH3(aq) + H2O(l) ⇌ NH4+(aq) + OH−(aq)
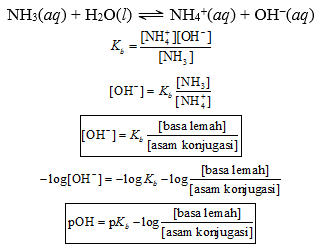
Jika b = jumlah mol basa lemah, g = jumlah mol asam konjugasi, dan V = volum larutan penyangga,

Contoh Soal Larutan Penyangga
Tentukan pH larutan penyangga yang dibuat dengan mencampurkan:
a. 10 mL larutan CH3COOH 0,1 M dengan 10 mL larutan CH3COONa 1 M
b. 20 mL larutan CH3COOH 0,1 M dengan 10 mL larutan KOH 0,1 M
c. 40 mL larutan NH3 0,1 M dengan 4 mL larutan NH4Cl 0,1 M
Ka CH3COOH = 1 × 10−5; Kb NH3 = 1 × 10−5
Jawab:
a. Larutan penyangga dengan CH3COOH sebagai asam lemah dan CH3COONa sebagai garam basa konjugasi
a = mol CH3COOH = 10 mL × 0,1 mmol/mL = 1 mmol
g = mol CH3COO− = mol CH3COONa = 10 mL × 1 mmol/mL = 10 mmol

b. 10 mL larutan basa kuat KOH 0,1 M (1 mmol KOH) akan bereaksi dengan 20 mL larutan asam lemah CH3COOH 0,1 M (2 mmol CH3COOH) menghasilkan air dan garam basa konjugasi CH3COOK.
CH3COOH(aq) + OH−(aq) ⇌ CH3COO−(aq) + H2O(l)

c. Larutan penyangga dengan NH3 sebagai basa lemah dan NH4Cl sebagai garam asam konjugasi
b = mol NH3 = 40 mL × 0,1 mmol/mL = 4 mmol
g = mol NH4+ = mol NH4Cl = 4 mL × 0,1 mmol/mL = 0,4 mmol

Referensi:
Brown, Theodore L. et al. 2015. Chemistry: The Central Science (13th edition). New Jersey: Pearson Education, Inc.
Lew, Kristi. 2009. Essential Chemistry: Acids and Bases. New York: Chelsea House.
McMurry, John E., Fay, Robert C., & Robinson, Jill K. 2016. Chemistry (7th edition). New Jersey: Pearson Education, Inc.
Petrucci, Ralph H. et al. 2017. General Chemistry: Principles and Modern Applications (11th edition). Toronto: Pearson Canada Inc.
Purba, Michael. 2006. Kimia 2B untuk SMA Kelas XI. Jakarta: Erlangga.
Retnowati, Priscilla. 2005. SeribuPena Kimia SMA Kelas XI Jilid 2. Jakarta: Erlangga.
Artikel: Larutan Penyangga
Kontributor: Nirwan Susianto
Alumni Kimia FMIPA UI
Materi StudioBelajar.com lainnya:
